來源于:原創 王昭月 生物探索
已有研究表明,某些分子能夠增加癌細胞中腫瘤抑制蛋白PP2A的活性,從而殺死癌細胞以縮小細胞系和動物模型中的腫瘤。但其作用機制尚不清楚。基于此,密歇根大學的科學家們發現小分子DT-061可以特異性地穩定B56α-PP2A全酶,從而使其去磷酸化以達到抑癌效果。該研究成果發表在《cell》期刊上。
doi.org/10.1016/j.cell.2020.03.038
PP2A酶家族由三聚磷酸酶組成,即支架“A”亞基、催化“C”亞基和調節“B”亞基。其中,該蛋白的去磷酸化能力主要是由40多個決定特異性的調節“B”亞基競爭異質PP2A三聚體的組裝和激活而調控的。通常一系列小分子PP2A激活劑(small molecule activators of PP2A,SMAPs)在一些體內腫瘤模型中可驅動c-Myc和ERK等特定致病底物的去磷酸化,從而協同抑制腫瘤。
小分子DT-061屬于典型的SMAP,研究者利用細胞分離熒光素酶系統、免疫共沉淀(coIP)實驗等,發現DT-061在細胞培養和體內都可以選擇性地增強含有PP2A全酶種群的B56α。單獨表達和純化PP2A各亞基,發現DT-061可以直接穩定AB56αC異種三聚體。
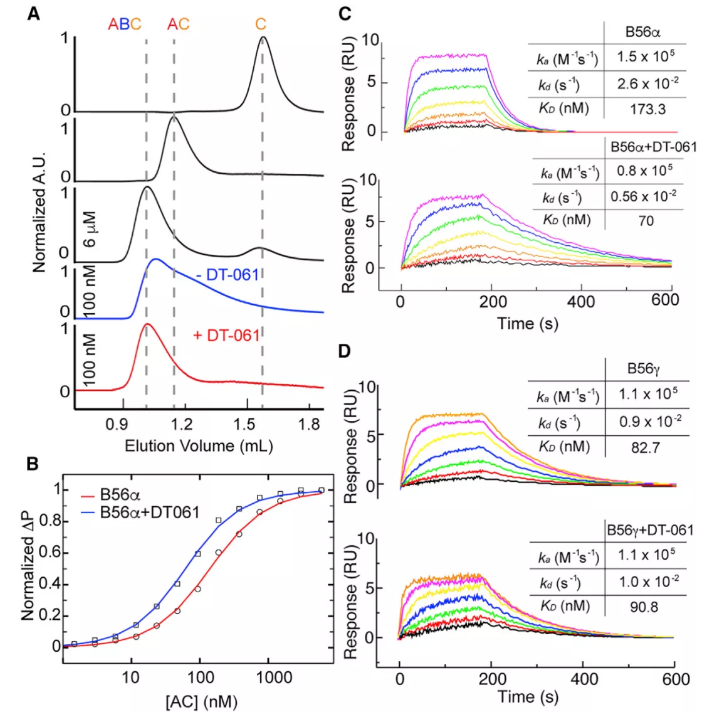
DT-061直接穩定AB56αC異種三聚體
然后利用單粒子低溫電子顯微鏡(cryo-EM)來觀察藥物結合PP2A復合體的三維結構,發現DT-061結合在PP2A亞基間的獨特“口袋”中,并與所有三個PP2A亞基的殘基相互作用,其獨特的穩定機制幫助我們揭示了一個難以捉摸和不對稱的磷酸酶異質三聚體的結構。
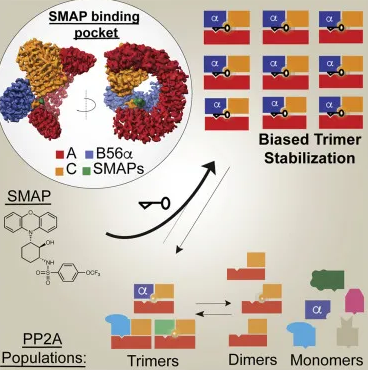
SMAPs選擇性地穩定三亞單元以偏置磷酸酶PP2A
總之,研究者發現SMAPs結合在所有3個PP2A亞基間的“口袋”中,DT-061(SMAP)可以特異性穩定B56α-PP2A全酶,使后者可選擇性地對底物如c-Myc去磷酸化。而甲基化的B56α異三聚體的積累可作為一種潛在的臨床生物標志物。
研究者還表示,除了癌癥,PP2A在心血管和神經退行性疾病等其他疾病中也出現失調現象,因此,該發現也為開發治療心力衰竭和老年癡呆癥等的新藥提供了機會。
End
參考資料:
[1] Turning on the 'off switch' in cancercells.
[2] Selective PP2A Enhancement ThroughBiased Heterotrimer Stabilization, Cell (2020).


